A tomografia por emissão de positrões (PET) e a ressonância magnética (MRI) são amplamente usadas in vivo tanto clinicamente, como em aplicações para investigação biomédica. Os pontos fortes da MRI centram-se na alta resolução, alto contraste morfológico da imagem de tecidos moles; a capacidade de imagem de parâmetros fisiológicos, como o a difusão e a alteração a nível de oxigenação neuronal resultante da simulação; medições dos níveis morfológicos usando as mudanças dos gráficos dos químicos. A PET permite imagens da distribuição biológica dos indicadores de radiação com alta sensibilidade, mas geralmente faltam imagens anatómicas do contexto e são de baixa resolução especial. A integração destas tecnologias permite a aquisição de dados temporalmente correlacionados mostrando a distribuição de indicadores de radiação PET e agentes de contraste MRI ou MR – metabolismos detectáveis, com registo subjacente à anatomia. Foi construído um scanner compatível com a PET e a MRI para investigação biomédica que permite que aplicações de dados de ambas as modalidades sejam adquiridas em simultâneo. Experiências realizadas demonstraram a inexistência de efeitos do sistema MRI na resolução espacial no sistema PET e uma resolução <10%>
A tomografia por emissão de positrões (PET) permite imagens in vivo da distribuição de biomoléculas (pequenas moléculas, péptidos, anticorpos e nanopartículas) marcadas através de radionuclídeos que sofrem decaimento e produzem aproximadamente 511-keV pela aniquilação de fotões. Devido à alta sensibilidade dos ensaios radioactivos, a PET pode medir pequenas concentrações de biomoléculas marcadas. Uma grande variedade de alvos moleculares e os seus percursos foram digitalizados usando indicadores de radiação PET, com ávida acumulação do indicados de radiação [18F2]-2-fluoro-2-dióxido-D-glucose (FDG) em tumores malignos, sendo apenas um exemplo que tem aplicações difundidas na actividade clínica e no estudo de estratégias terapêuticas para o tratamento de tumores em animais-modelo. Contudo, a resolução da PET é limitada por factores físicos associados à física do positrão e pela dificuldade em obter estatísticas suficientes. Além disso, nas imagens PET falta, muitas vezes, informação anatómica definitiva, tornando difícil a localização exacta da acumulação do indicador de radiação.
A ressonância magnética (MRI) pode fornecer imagens anatómicas de alta resolução espacial de tecidos moles em contraste, explorando as diferenças nos tempos de relaxamento dos protões em diferentes ambientes bioquímicos. A combinação de alta resolução espacial e contraste permite observar consequências anatómicas (por exemplo, o crescimento tumoral, atrofia cerebral, anormalidades cardíacas) de muitas doenças em pacientes e em animais-modelo. As técnicas funcionais da MRI podem medir parâmetros fisiológicos importantes, incluindo a difusão, permeabilidade e as alterações dos níveis de oxigenação sanguínea após activação neuronal. O vício de agentes de contraste passivos baseados em gadolíneo ou em nanopartículas de óxido de ferro podem reforçar ainda mais o contraste. Alguns laboratórios encontram-se, também, a desenvolver agentes de contraste orientadores MRI. A MR espectroscopia (MRS), que mede a variação da frequência com que os protões ressoam em diferentes ambientes químicos, permite que sejam medidas as concentrações relativas de metabolitos abundantes e de algumas drogas administradas em massa. Com a MRS localizada, também podem ser obtidas imagens espectroscópicas comuns. O protão MRS é particularmente útil no estudo de tumores e também oferece informações sobre a integridade neuronal em doenças neurodegenerativas. No entanto a sensibilidade molar da ressonância magnética para diferentes metabolitos e marcadores é de muitas ordens de grandeza abaixo da PET, impondo restrições significativas sobre os tipos de metas que podem ser visualizadas.
Limpar as sinergias existentes entre as duas modalidades, porque cada uma pode fornecer informações exclusivas não atingíveis com a outra modalidade. Por esta razão a MRI e a PET são frequentemente combinadas em diagnósticos clínicos e em investigação. Relevante para o presente trabalho, estas modalidades têm sido cada vez mais utilizadas em investigação biomédica básica, em especial nos esforços para compreender a etiologia e evolução de doenças humanas em modelos animais adequados e na pré-avaliação de novas estratégias terapêuticas, tendo em conta pequenas moléculas de drogas, péptidos e anticorpos, terapias celulares, terapias genéticas e terapias à base de nanopartículas. Em particular, estas modalidades podem ser usadas em simultâneo para estudar a farmacodinâmica de novas terapias.
Até à data, a PET e a MRI são adquiridas em sistemas de imagem separados e combinados usando software que utiliza a informação contida nos dados da imagem ou em marcadores que podem ser claramente identificados nas duas imagens. Esta abordagem funciona bem no cérebro, onde o crânio limita o movimento e permite o registo simples de corpos rígidos. Contudo, torna-se mais problemática no tórax, abdómen e regiões pélvicas, onde se deformam tecidos e órgãos com base na posição do sujeito no scanner, e onde existem variações temporais, como o esvaziamento do conteúdo estomacal, a circulação de alimentos a través do intestino e o enchimento da bexiga, também dificultam o registo. Podem ser utilizadas técnicas de registo de imagens deformáveis, mas o seu sucesso é altamente dependente da situação, e elas, geralmente, não são robustas na presença de movimentos significativos de tecido entre os dois estudos das imagens em separado. A aquisição seria, portanto, uma garantia espacial no registo dos dois dados.
Mais decisivo é o facto da PET e da MRI não permitirem a correlação temporal. Os sistemas biológicos são inerentemente dinâmicos e a sua resposta a drogas e a agentes de contraste é fortemente dependente do tempo. A bio distribuição de muitos agentes de contraste e drogas exibe as alterações em escalas de tempo de minutos e segundos. Para garantir que um assunto está a ser digitalizado no mesmo estado fisiológico e para correlacionar as mudanças ao longo do tempo nos sinais PET e MRI em resposta a uma intervenção, exige, muitas vezes, que os dados sejam adquiridos em simultâneo. Para dar apenas um exemplo, pode querer controlar alterações dinâmicas na fisiologia de um tumor com a MRI enquanto digitaliza a entrega de agentes terapêuticos radiomarcados ou faz a avaliação da bioquímica do tumor. A aquisição simultânea de dados da PET e da MRI usando um dispositivo integrado de representação gráfica é, por conseguinte, necessária para responder a muitas questões biomédicas importantes na dinâmica de sistemas vivos. Na concepção de um scanner integrado para PET e MRI simultâneas, um desafio óbvio diz respeito às formas em que os sistemas PET e MRI podem interferir uns com os outros, o que conduz a grandes artefactos e/ou degradação de imagem. As principais preocupações são as interferências electromagnéticas (EMI) e o feito do campo magnético principal (B0) da MRI sobre os detectores no scanner PET; contudo, outras, mais subtis, com os efeitos que precisam de ser considerados, incluem a indução de correntes em turbilhão, a susceptibilidade de artefactos e um aumente de temperatura ou vibrações induzidas pelo funcionamento das sequências MR. Os detectores e a electrónica normalmente associada aos scanners PET são sensíveis aos campos magnéticos e contêm condução e radiofrequência (RF) de componentes radiantes que têm potencial para interferir com o sistema MRI. Por exemplo, os PMTs são afectados por fracos campos magnéticos. Devido à sua elevada sensibilidade, os materiais ferromagnéticos normalmente não são úteis, ou mesmo toleráveis, dentro do campo da MRI e, consequentemente, devem ser evitados.
As abordagens mais rápidas para o desenvolvimento de sistemas combinados PET-MRI utilizam fibra óptica muito longa nas conexões entre os elementos do citinlador e PMT para eliminar efectivamente a EMI entre os dois sistemas. Embora esta situação tenha levado a dados com provas iniciais, incluindo um pequeno número de estudos animais, o desempenho do scanner PET era pobre em comparação com o scanner PET independente e o comprimento das fibras ópticas tornaram o sistema pesado. Uma variação sobre este projecto, usando um íman dividido em que os detectores PET residem no fosso e as fibras de emanar residem radialmente do íman, se bem que ainda limitada pela transmissão da luz cintilante através de longas fibras ópticas e baixa intensidade do campo do íman em comparação com a maioria dos scanners PET pré-clínicos.
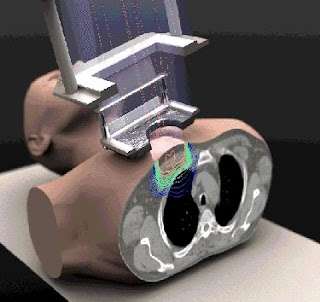
Optámos por uma abordagem diferente no desenvolvimento de um scanner PET inserido que é compatível com o actual campo forte do sistema MRI. Utilizámos um campo magnético insensitivo com avalanche de fotodíodo (APD) no lugar de detectores PMTs e usámos uma grande quantidade de fibras ópticas muito pequenas para posicionar apropriadamente os fotodetectores e a electrónica PET respeitado a MRI RF e bobinas, para minimizar a interferência. Em breve, a PET inserida compreende 16 módulos detector arranjados num anel simétrico.
Cada módulo detector PET consiste numa matriz de lutécio oxiortosilicatado (LSO), detectores acoplados através de um feixe de fibras ópticas dobradas para uma posição de sensibilidade APD (PSAPD) e uma carga sensitiva de pré-amplificadores montados numa placa de circuito impresso povoado de componentes não magnéticas. Todos os 16 módulos são montados num tubo de fibras de carbono e os cristais em LSO ordenados por oito anéis detectores completos no centro da inserção. Os PSAPDs e os fotodetectores são blindados por um tonel laminado e estão localizados no scanner MRI de maneira que estão axialmente fora da região linear do campo do gradiente-z e fora do volume de imagem definido pela bobina RF. Os detectores são arrefecidos a -10ºC usando ar fresco refrigerado e ar seco para obter uma óptima relação sinal – ruído a partir dos PSAPDs e para minimizar a temperatura acumulada. A PET inserida é compatível com os existentes scanners MRI pré-clínicos tendo um furo nítido de 12 cm ou maior. O PET inserido é posicionado no scanner MRI utilizando um registo com o scanner PET e MRI onde sejam visíveis marcadores seguros de tal forma que os isocentros dos campos de visão (FOVs) PET e MRI sejam coincidentes. O PET inserido é facilmente removido, permitindo-lhe e ao scanner MRI serem utilizados como dispositivos independentes.
Outros grupos têm prosseguido abordagens semelhantes, mas sem a ligação de fibras ópticas, colocando os APDs e a electrónica no volume activo MRI. Esta abordagem irá melhorar o desempenho da PET por eliminar a luz cintilante perdida nas fibras ópticas; contudo, a aproximação dos APDs à bobina RF e gradientes têm o potencial de aumentar a interferência entre os sistemas, especialmente para sequências de pulso MRI que a procura intensa do gradiente de comutação e de alta intensidade de pulsos RF.
Aqui descrevemos de forma detalhada fantasmas de experiências realizadas com o scanner PET-MRI compatível para demonstrar que a PET e MRI podem ser adquiridas em simultâneo, sem interferência significativa entre as duas modalidades. Também levámos a cabo uma série de estudos in vivo para destacar as aplicações biomédicas para esta tecnologia.
Resultados e Discussão
Efeitos do sistema MRI sobre o sistema PET. Experiências para analisar a interferência entre os dois sistemas de imagiologia quando adquirem dados PET e MRI simultaneamente foram concebidas para caracterizar o efeito de um sistema de aquisição de imagem protocolo sobre o outro. A PET detectora de mapas (que mostra um histograma dos eventos detectados pelo cintilador 8 x 8 elementos num particular módulo detector PET quando é uniformemente irradiada com uma fonte de 511-keV – aniquilação de fotões) demonstra uma pequena rotação (horária ou anti-horária, dependendo da orientação das PSAPDs no que diz respeito ao campo magnético) quando o PET inserido no interior do íman (fig. 1 A e B), devido à força magnética sobre os electrões que se deslocam através do silício. No entanto, a capacidade para resolver o detector de cristais, que é uma chave que contribui para a resolução espacial na PET, não foi sensivelmente alterada no íman 7-T.
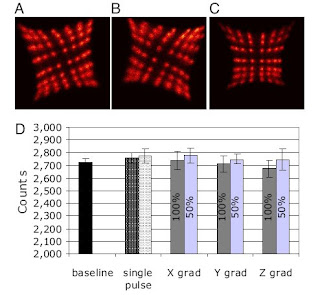
Fig. 1. MR scanner effect on PET system. (A–C) Detector histograms showing the anticlockwise (A) and clockwise (B) rotations of the crystal maps when compared with the data acquired outside of the magnet (C). (D) PET event rate measured under different conditions: (i) while applying only RF power (with 1,000 ms and 500 ms repetition times) and (ii) while switching the x–z gradients independently (at 100% and 50% power; 400 and 200 mT/m, respectively). Baseline represents the event rate recorded without running MR sequences.
Adquirir uma imagem MR requer o uso de fortes impulsos RF mudanças rápidas de gradiente de campo magnético que têm o potencial para perturbar o fraco sinal electrónico produzido pelos detectores PET. Por isso, as medições PET foram tomadas durante uma corrida de sequências MRI que são normalmente utilizadas em pequenos estudos animais, tais como RARE (rápida aquisição com relaxamento acessório) e FLASH (tiro rápido de baixo ângulo).
Não houve diferença na resolução espacial do scanner PET observada quando operados no scanner MRI com RARE (1.18 + / - 0,02 mm), SE (spin echo) (1,19 + / - 0,01 mm), ou FLASH (1.19 + / - 0,01 mm) sequências de pulso versus resoluções espaciais de 1.19 + / - milímetros medidos dentro do íman sem correr sequências de pulso. Isto demonstra que não existe distorção espacial observável nos dados PET no ambiente MRI. A resolução da energia dos detectores PET (que é importante para rejeitar a aniquilação de fotões que têm inelasticidade dispersos pelo corpo e que perderam as suas informações posicionais) também está inalterada durante as sequências de pulso MRI. A sensibilidade absoluta medida (fracção de decaimento radioactivo levando a um caso detectado no scanner PET) no PET inserido foi 0.6% no centro do FOV (CFOV). Não foi detectada alteração na sensibilidade enquanto decorre uma sequência padrão SE. No entanto, uma diminuição de 10% e 7% na taxa de evento foi observada enquanto decorriam as sequências FAST e RARE, respectivamente. Isto sugere que uma pequena fracção dos eventos é removida do fluxo de dados da PET. Outras experiências nas quais a excitação RF e o gradiente de comutação foram aplicadas separadamente revelando que o efeito é provavelmente causado pelo gradiente de comutação (fig. 1D). Esta interferência ocorre apenas durante uma pequena fracção do ciclo da sequência de pulso e estes eventos são rejeitados pelo scanner PET por não satisfazerem os critérios do pulso de altura.
Efeitos do sistema PET sobre o sistema MRI. A presença do PET inserido no íman tem o potencial para causar artefactos ou para degradar o sinal para ruído (SNR), no sinal MR, o que poderia reduzir a qualidade da imagem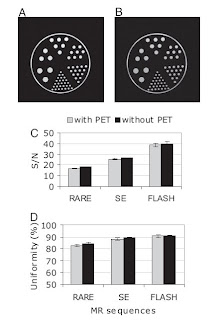
Fig. 2. PET insert effects on MR imaging. (A and B) SE (A) and GE (B) images of a structured phantom acquired in the presence of the PET insert. (C and D) SNR (C) and uniformity (D) measured for several pulse sequences with and without the PET insert, using a uniform phantom.
Por isso, as imagens MR foram comparadas com e sem o PET inserido. As imagens MR de um modelo anatómico estruturado na presença do PET inserido ligado com uma determinada sequência de pulso não apresentam qualquer distorção nem artefactos óbvios (fig. 2 A e B). Subtraindo imagens, na presença do PET inserido ligado e desligado, demonstram um ruído de fundo incaracterístico. Numa experiência em separado, SNR médio (fig. 2C) e imagem em uniformidade (fig. 2D) com e sem PET inserido para diferentes sequências de pulso, usando um modelo anatómico homogéneo. O maior decréscimo no SNR causado pelo PET inserido foi com a sequência RARE (-8%, P = 0.0001), enquanto que um menor decréscimo (-3%, P = 0.0001) foi observado para a sequência SE. Do mesmo modo, a maior queda na uniformidade verificou-se no caso da sequência RARE (-2%). Pequenas mudanças (-1%) foram observadas para a sequência SE e não se registaram mudanças para a sequência FLASH.
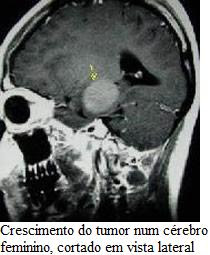
PET e MRI simultâneas in vivo em pequenos animais. Estudos de imagiologia num rato in vivo revelaram que o sistema multimodal combinado produz informação consistente numa configuração do mundo real. Um rato injectado com 10(6) células de MC38 foi digitalizado após 10 dias, quando o tumor tinha chegado a » 9 mm de diâmetro. A imagem simultânea FDG PET e MRI anatómica (fig. 3A) demonstra um foco hiper intenso de FDG coincidente com a localização do tumor.
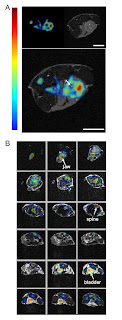
Fig. 3. Simultaneous in vivo PET and MR imaging. (A) Mouse FDG tumor imaging. (Upper Left) PET image, (Upper Right) MR image, and (Lower) fused PET and MR image. One transaxial image slice is shown. (B) Fused PET and MR images of a mouse. Transaxial sections from top of head to bladder are shown. (Scale bars, 5 mm.) The same false-color look-up table is used in both A and B.
A aceitação é heterogénea e uma região de hiper intensidade na MRI próxima do centro do tumor mostra baixa absorção de FDG (ver seta na fig. 3A), provavelmente indicativa de necrose. Este exemplo mostra o potencial do estudo combinado PET/MRI para melhorar a interpretação do cancro em estudos de imagiologia em tumores heterogéneos com tecidos malignos, necrose e edema que não são separáveis por ressonância magnética. A imagem completa do organismo animal é importante em muitos estudos (por exemplo, em células de monitoramento, tratamento de imagens primárias de metástase, respostas imunológicas em cancro e detecção de placas vasculares). Apesar de o FOV axial do MRI compatível com o PET inserido ser apenas 12 mm, a imagem do organismo completo foi realizada com o movimento do animal com os dois sistemas de imagem e de aquisição de dados que abrangiam a totalidade do animal (fig. 3B). Esta análoga à forma como o estudo de imagiologia é feito a todo o corpo humano pela PET. O marcador de radiação administrado foi Na18F – ião fluoreto acumulado nas estruturas ósseas devido à incorporação na apetência de cristais. A mandíbula é bem visível na linha superior, a coluna vertebral pode ser bem detectadas nas últimas 10 imagens e da bexiga é vista a acumulação nítida de 18F. A s imagens PET e MRI mostram um excelente registo ao longo de todo o eixo do corpo. Este exemplo mostra o potencial do sistema para todo o estudo de todo o organismo com a distribuição de marcadores de radiação e, nomeadamente, o uso do ião 18F é relevante na PET/MRI para estudar o sistema esquelético em modelos de osteoporose, artrite e metástases ósseas.
Para além da MRI morfológica: avançadas técnicas MR realizadas na presença do PET inserido. A MRS move métodos MR no domínio das medições metabólicas, permitindo que o sinal de metabolitos seja abundante para ser digitalizado, embora com uma dimensão espacial bastante grosseira. A combinação de medições PET e MRS também oferece muitas oportunidades. Para demonstrar que a MRS pode ser realizada na presença do PET inserido em funcionamento, foi adquirido um espectro de protão a partir de um cubo voxel de tamanho 3x3x3 mm3 posicionado centralmente no cérebro do rato normal (fig. 4A).

Fig. 4. Advanced MR measurements. (A) In vivo MR spectroscopy; mouse 1H brain spectrum acquired in the presence of the PET insert. (B) ADC map of an in vivo mouse brain acquired by using a four-shot EPI sequence in the presence of the PET insert. ADC units are 10–3 mm2/sec. (Scale bar, 2 mm.)
Os três singlet e uma ressonância doublet correspondentes a NAA, Cho, Cr e picos de LAC, respectivamente, podem ser observados nos dados do rato. Ao adquirir estes dados em simultâneo com a PET, seria possível correlacionar temporalmente a dinâmica dos sinais PET e MRS. Adicionalmente, a biodistribuição e o metabolismo de drogas contendo fluoreto poderiam ser estudadas simultaneamente por uma combinação de 18F PET em vestígios 19F MRS montantes em massa.
Uma das mais exigentes, ainda que útil, sequências para a realização de estudos da ressonância magnética funcional (fMRI) é o EPI (echo planar imaging). Pelo facto desta sequência empregar gradientes fortes e rápidos, é potencialmente uma das mais difíceis de executar no sistema combinado. Como prova de princípio, bidimensional, quatro EPI com difusão de imagens ponderada (DWI-EPI) foram atingidos, na presença do PET inserido. DWI é baseada na medição do movimento das moléculas de água nos tecidos biológicos e os mapas de difusão podem ser obtidos através da medição da difusão aparente de coeficientes (ADCs) para todos os voxels na região de interesse. A fidelidade do mapa ADC para leitura de valores ilustra que o PET inserido não tem qualquer efeito importante sobre o desempenho da instrumentação MR, mesmo sob estas condições exigentes. Métodos DWI têm-se revelado importantes para avaliar processos patológicos numa série de condições, tais como acidente vascular e cancro. A combinação de medições PET e fMRI permitirá diferentes fases de uma complexa resposta farmacological. Por exemplo, os substratos radiomarcados PET e ligantes poderiam ser utilizados a taxa de síntese de dopamina, transporte e expressão de recepção, enquanto fMRI é usada para estudar activação neuronal após estimulação por anfetaminas ou cocaína.
Em conclusão, temos demonstrado a viabilidade de estudos simultâneos PET e MRI, o que mostra que, com bom desenho, não há grandes artifícios ou perda em performances que são vistas em toda uma série de condições MRI. Assim, qualquer um dos dois sistemas de imagiologia desempenha essencialmente o mesmo, quer o outro esteja presente ou não. Não se pode excluir, nesta fase, a presença de artefactos subtis de efeitos de segunda ordem que podem resultar em pequenas mudanças na relação sinal-ruído em uma ou em ambas as modalidades. No então estudos simultâneos PET e MRI de alta qualidade têm sido demonstrados tanto em modelos anatómicos como in vivo. Uma série de desafios continuam. Embora o desempenho do scanner PET não esteja a afectar indevidamente o sistema MRI, a concepção deste protótipo, em termos de sensibilidade, só aproxima a primeira geração de scanners PET desenvolvidos para animais nos finais dos anos 90 (embora este ainda seja suficiente para muitos estudos interessantes). Para desenhar um MR compatível inserido existe competitividade com os sistemas PET independentes será exigido um longo FOV axial e detectores mais eficientes. A utilização de detectores de codificação mais espessos e de um scanner desenhado que dobra a FOV axial, levando a um aumento> 8 da sensibilidade, deve ser explorada. Com excepção desta questão, não há qualquer razão para que a tecnologia aqui desenvolvida não possa ser traduzida para representação gráfica de temas mais abrangentes, incluindo os seres humanos.
Neste trabalho, demonstrámos que o scanning simultâneo da PET e MRI é viável e prático na área de pequenos animais. As imagens de roedores in vivo aqui apresentadas apoiam o potencial deste método de imagiologia multimodal numa série de aplicações, incluindo o monitoramento de moléculas e células, estudos farmacodinâmicos/farmacocinéticos de tecidos com consumo de droga com receptores de ocupação (via PET). A fusão destas duas modalidades permite-nos, de uma forma sinérgica, enormes vantagens de ambas as técnicas.
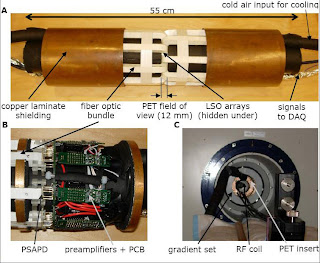
MR-compatible PET scanner. (A) Photograph of the PET insert. (B) Close-up view showing PSAPDs and associated electronics that reside under the high-frequency copper laminate. (C) PET insert in place within the 7-T Bruker BioSpin preclinical MRI system. DAQ, data acquisition; PCB, printed circuit board.